|
UWS Delfin Homberg e.V. |
|
Tauchphysik Gesetz von Henry |
|
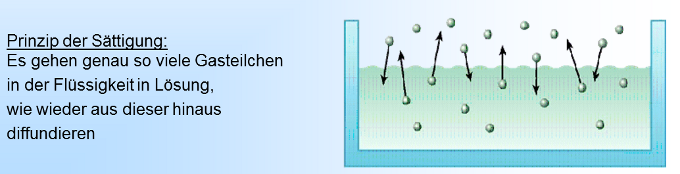
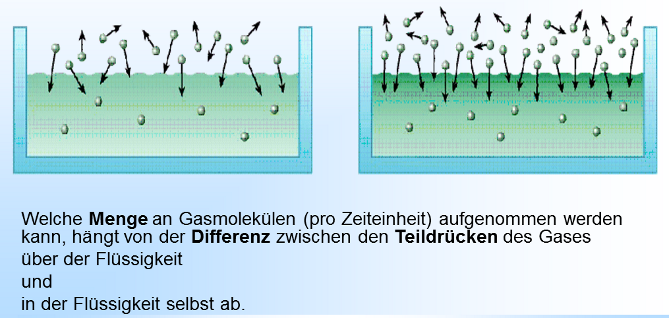
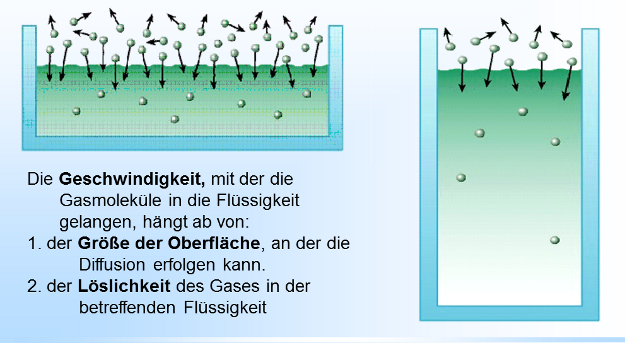
Wenn wir eine neue Sprudelflasche öffnen, zischt es und aus der Flüssigkeit perlt Kohlensäure aus. Woher kommt dieses Gas auf einmal und warum perlt es jetzt aus? Der Grund liegt in der Löslichkeit von Gasen in Flüssigkeit. Das zugrunde liegende Prinzip wird beschrieben im: Gesetz von Henry Die Menge eines in Flüssigkeit gelösten Gases ist abhängig von der Temperatur und dem Druck über der Flüssigkeit. Gase lösen sich in Flüssigkeiten, d.h. dass die Gasmoleküle in die Flüssigkeit diffundieren. Gleichzeitig treten Gasmoleküle auch wieder aus der Flüssigkeit aus. Flüssigkeiten können abhängig vom Druck eine bestimmte Anzahl Moleküle einlagern. Ist diese Genze erreicht, spricht man davon, dass eine Flüssigkeit gesättigt ist, d.h. es treten aus einer Flüssigkeit genauso viele Gasmoleküle aus der Flüssigkeit, wie in sie eindringen. Erhöht man den Gasdruck, werden so lange mehr Moleküle in die Flüssigkeit eindringen als austreten, bis der Sättigungszustand für diesen Druck erreicht ist. Senkt man den Gasdruck, werden so lange mehr Moleküle aus der Flüssigkeit austreten als eindringen, bis der Sättigungszustand für diesen Druck erreicht ist. Die Zeitdauer, bis dieses Gleichgewicht erreicht ist hängt vom Druckunterschied, der Größe der Oberfläche und dem Löslichkeitskoeffizienten dieses Gases ab. Diesen Vorgang der Diffusion in und aus eine Flüssigkeit kann man normalerweise nicht sehen. Wird jedoch der Druck zu schnell gesenkt, wie bei der Sprudelwasserflasche, dann werden die Gasmoleküle nicht einzeln, sondern als Gasblasen aus der Flüssigkeit ausperlen. |
|
Beim Beispiel Sprudel wird das Gas unter Druck in der Flüssigkeit gelöst. Solange die Flasche geschlossen, also unter Druck bleibt, bleibt auch das Gas gelöst. Sobald man den Verschluss öffnet, kommt es zu einem Druckabfall und einem Ausperlen des Gases.
Auswirkungen für Taucher Wir nehmen durch die Atmung das Inertgas Stickstoff auf und geben es durch die Atmung auch wieder ab. Unser Körper ist an Land mit Stickstoff gesättigt. Gehen wir tauchen, diffundiert sich durch den erhöhten Druck nach Henrys Gesetz entsprechend mehr Stickstoff in unseren Geweben ein. Je tiefer (höherer Druck) und länger (Aufsättigungsperiode) wir tauchen, desto mehr Stickstoff sammelt sich in unseren Geweben. Tauchen wir wieder auf, kehrt sich das Druckgefälle um und der Stickstoff wird wieder aus den Geweben abgebaut. Sowohl Auf- wie auch Entsättigung geschehen über die Atmung und den Blutkreislauf. Wenn die Druckentlastung zu schnell vor sich geht (zu schnelles Auftauchen), dann werden sich auch in unserem Körper im Blut die Stickstoffmoleküle zu Bläschen zusammenrotten und damit den sogenannten Dekounfall (DCS) auslösen. Beim Auftauchen müssen wir deshalb den Druck entsprechend langsam absenken, um eine sprunghafte Entsättigung mit Blasenbildung zu vermeiden. Insgesamt zeigt das Henrysche Gesetz, wie wichtig die Kontrolle der Tauchgeschwindigkeit und die Einhaltung von Dekompressionsrichtlinien für die Gesundheit und Sicherheit von Tauchern sind, um die negativen Auswirkungen der Gaslöslichkeit und Blasenbildung zu minimieren. Mehr dazu gibt es im Medizinteil im Kapitel "Dekompression" und "Dekompressionskrankheit (DCS)". |
|
1.6 |